DÉFINITIONS
Un
acide (au sens de Brönsted) est une molécule ou un ion susceptible de libérer un (ou : des) proton(s)
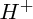
; exemple :

(gazeux), qui, par dissolution dans l'eau, donne
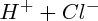
.
Le pH : c'est une valeur numérique, qui se mesure dans les solutions ; elle vaut :
![$ -\log[H^+] $ $ -\log[H^+] $](/latexrender/pictures/940730d638472160d025c86d1adee4a9.png)
; ainsi : plus le pH est faible, plus
![$ [H^+] $ $ [H^+] $](/latexrender/pictures/032440d7534caf9c802fd336d0221d67.png)
est grande (plus la solution est acide). Quand une solution contient peu de
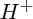
, on dit qu'elle est
basique.
Remarque : ci-dessus, et dans tout ce qui suit, on parle de
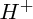
comme si c'était une entité chimique stable ; en réalité, toutes les réactions que nous allons étudier se déroulent en solution (et, au programme, il n'y a que des exemples de réactions en solution aqueuse) : or, en solution,
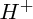 est solvaté
est solvaté ; ainsi, dans l'eau, il se trouve presque exclusivement sous la forme :
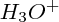
. C'est par souci de simplicité d'écriture, que nous allons continuer à l'appeler
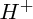
.
COUPLES ACIDO-BASIQUES
Lorsqu'un acide libère un proton, il donne un produit éventuellement susceptible de gagner un proton, pour reformer l'acide de départ ; ainsi, l'acide éthanoïque (CH
3COOH) donne CH
3COO
- + H
+ , qui peuvent à nouveau réagir ensemble pour redonner CH
3COOH ; une molécule ou un ion qui (tel CH
3COO
-) peut fixer un (ou des) proton(s) est appelé : base. Ainsi, de la même manière qu'on définit les couples redox (couples d'entités chimiques susceptibles de se transformer l'une en l'autre, en consommant ou en libérant des électrons), on définit
les couples acido-basiques : ce sont des couples d'entités chimiques qui dérivent l'une de l'autre par libération, ou fixation, d'un proton ; l'acide et la base d'un couple acido-basique sont dits : conjugués.
ACIDES FORTS ET FAIBLES, BASES FORTES ET FAIBLES
On appelle
" acide fort " un acide qui, dans l'eau, réagit totalement pour donner sa base conjuguée (et H
+). C'est à dire que, dès qu'on met cet acide (notons-le : AH) dans l'eau, il réagit pour donner sa base conjuguée (notons-la : A
-) et H
+, et ces deux espèces ne réagissent pas l'une sur l'autre pour redonner AH. La solution ne contient donc que la base conjuguée, et H
+ solvaté, mais plus d'acide AH.
C'est notamment le cas de
l'acide chlorhydrique : quand on dissout HCl dans l'eau, il se forme H
+ et Cl
-, et Cl
- ne reréagit pas avec H
+ pour redonner du HCl.
On appelle " acide faible " un acide qui, dans l'eau, donne sa base conjuguée par une réaction équilibrée : la base conjuguée peut réagir avec H
+, pour redonner AH ; la solution contient donc à la fois AH, et A
-. Exemple d'acide faible : l'acide éthanoïque.
De même,
une base forte réagit totalement pour donner son acide conjugué (exemple : l'ion éthanolate C
2H
5O
-, qui, dans l'eau, réagit totalement pour donner l'éthanol C
2H
5OH), et une base faible réagit de manière équilibrée pour donner son acide conjugué.
Ainsi : la base conjuguée d'un acide faible, est une base faible.
La base conjuguée d'un acide fort (exemple : Cl
-, qui, dans l'eau, ne peut pas réagir avec H
+ pour donner HCl) est dite : " hyperfaible ". De même, l'acide conjugué d'une base forte (exemple : C
2H
5OH, acide conjugué de C
2H
5O
-) est dit " hyperfaible ".
RÉACTIONS DE DEUX COUPLES ACIDO-BASIQUES
Comme dans le cas des couples redox :
l'acide d'un couple n°1 peut réagir sur la base d'un couple n°2, pour donner la base du couple n°1, et l'acide du couple n°2.
Pour déterminer le sens de la réaction, on classe les couples acido-basiques selon
l'échelle des pKa .
définition :
![$ pKa = -\log\left(\frac{[A^-].[H^+]}{[AH]}\right) $ $ pKa = -\log\left(\frac{[A^-].[H^+]}{[AH]}\right) $](/latexrender/pictures/03a7abc1a2e85fed4cb550e5acd63c1b.png)
propriété : pour un couple acido-basique donné, à une température donnée, le pKa est constant.
Plus le pKa d'un couple est bas, plus l'acide de ce couple est fort (puisque, d'après l'expression mathématique du pKa, plus [AH] est faible, et plus
[A
-].[H
+] sont forts, plus le pKa est bas : ainsi, plus l'acide est dissocié en A
- + H
+, plus le pKa est bas ; or, le taux de dissociation de l'acide reflète sa faculté à libérer son proton).
Donc, si le pKa du couple n°1 est plus bas que celui du couple n°2, la réaction :
acide 1 + base 2 -> base 1 + acide 2
sera prépondérante par rapport à la réaction :
base 1 + acide 2 -> acide 1 + base 2.
Cas de l'eau
La molécule H
2O participe à deux couples acido-basiques distincts : le couple H
3O
+/H
2O (dans lequel elle joue le rôle de base), et H
2O/OH
- (dans lequel elle joue le rôle d'acide). Une telle entité chimique, qui peut jouer à la fois le rôle d'acide et de base, est appelée :
" amphotère ".
Toutes les réactions au programme de terminale se déroulent dans l'eau.
Conséquence : si une réaction libère un acide AH plus fort que H
3O
+, alors cet acide va immédiatement réagir avec H
2O pour donner H
3O
+ et sa base conjuguée A
-. Comme la réaction se déroule dans l'eau, l'acide AH trouvera toujours une molécule H
2O avec laquelle réagir (le solvant est en large excès devant les solutés). De fait,
un acide plus fort que H3O+ est instable dans l'eau (il réagit immédiatement avec l'eau).
De la même manière :
une base plus forte que OH- est instable dans l'eau (elle réagit immédiatement avec H
2O, qui est l'acide du couple H
2O/OH
-, pour donner OH
- et son acide conjugué).
EFFET TAMPON
On dit d'un couple acido-basique qu'il a un pouvoir tampon à un pH donné, lorsqu'une solution contenant l'acide et la base de ce couple a un pH qui varie peu :
1. lorsqu'on ajoute une petite quantité d'acide fort ;
2. lorsqu'on ajoute ajoute une petite quantité de base forte ;
3. lorsqu'on dilue modérément la solution.
On dit alors que la solution est
" tamponnée " : on a beau ajouter de l'acide fort, de la base forte, ou diluer la solution, son pH varie peu.
Les couples acido-basiques faibles ont un bon pouvoir tampon pour des pH voisins de leur pKa ; en effet, à pH = pKa :
![$ pH = -\log\left (\frac{[A^-].[H^+]}{[AH]}\right) $ $ pH = -\log\left (\frac{[A^-].[H^+]}{[AH]}\right) $](/latexrender/pictures/d91e183a074a7df038aa02749b273faa.png)
![$ -\log[H^+] = -\log\left(\frac{[A^-].[H^+]}{[AH]}\right) $ $ -\log[H^+] = -\log\left(\frac{[A^-].[H^+]}{[AH]}\right) $](/latexrender/pictures/c0f1be90ef393089eccc351365a25f77.png)
![$ -\log[H^+] = -\log[A^-] -\log[H^+] + \log[AH] $ $ -\log[H^+] = -\log[A^-] -\log[H^+] + \log[AH] $](/latexrender/pictures/ca31745a3840c8bbbacef920f886d600.png)
![$ \log[AH] -\log[A^-] = 0 $ $ \log[AH] -\log[A^-] = 0 $](/latexrender/pictures/e5201bc00bb8e1764b69ae43908424fe.png)
![$ \log[AH] = \log[A^-] $ $ \log[AH] = \log[A^-] $](/latexrender/pictures/4f08e1388efd5ed1f3c1f21db3e368ac.png)
![$ [AH] =[A^-]$ $ [AH] =[A^-]$](/latexrender/pictures/1a491666cb2886cc65ba88ecce0f3583.png)
(à pH=pKa
du couple, l'acide et la base du couple sont à la même concentration)
ainsi, au voisinage de pH=pKa, la solution contient de l'acide AH et de la base A
- en quantités notables tous les deux. Donc, si on ajoute de l'acide fort, il va réagir avec A
- (la base A
- consomme l'acide introduit : cet acide libère donc peu de H
+, donc le pH varie peu) ; de même, si on ajoute de la base forte, elle sera consommée par AH.
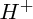 ; exemple :
; exemple :  (gazeux), qui, par dissolution dans l'eau, donne
(gazeux), qui, par dissolution dans l'eau, donne 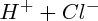 .
.![$ -\log[H^+] $ $ -\log[H^+] $](/latexrender/pictures/940730d638472160d025c86d1adee4a9.png) ; ainsi : plus le pH est faible, plus
; ainsi : plus le pH est faible, plus ![$ [H^+] $ $ [H^+] $](/latexrender/pictures/032440d7534caf9c802fd336d0221d67.png) est grande (plus la solution est acide). Quand une solution contient peu de
est grande (plus la solution est acide). Quand une solution contient peu de 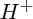 , on dit qu'elle est basique.
, on dit qu'elle est basique.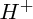 comme si c'était une entité chimique stable ; en réalité, toutes les réactions que nous allons étudier se déroulent en solution (et, au programme, il n'y a que des exemples de réactions en solution aqueuse) : or, en solution,
comme si c'était une entité chimique stable ; en réalité, toutes les réactions que nous allons étudier se déroulent en solution (et, au programme, il n'y a que des exemples de réactions en solution aqueuse) : or, en solution, 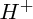 est solvaté ; ainsi, dans l'eau, il se trouve presque exclusivement sous la forme :
est solvaté ; ainsi, dans l'eau, il se trouve presque exclusivement sous la forme : 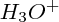 . C'est par souci de simplicité d'écriture, que nous allons continuer à l'appeler
. C'est par souci de simplicité d'écriture, que nous allons continuer à l'appeler 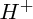 .
.![$ pKa = -\log\left(\frac{[A^-].[H^+]}{[AH]}\right) $ $ pKa = -\log\left(\frac{[A^-].[H^+]}{[AH]}\right) $](/latexrender/pictures/03a7abc1a2e85fed4cb550e5acd63c1b.png)
![$ pH = -\log\left (\frac{[A^-].[H^+]}{[AH]}\right) $ $ pH = -\log\left (\frac{[A^-].[H^+]}{[AH]}\right) $](/latexrender/pictures/d91e183a074a7df038aa02749b273faa.png)
![$ -\log[H^+] = -\log\left(\frac{[A^-].[H^+]}{[AH]}\right) $ $ -\log[H^+] = -\log\left(\frac{[A^-].[H^+]}{[AH]}\right) $](/latexrender/pictures/c0f1be90ef393089eccc351365a25f77.png)
![$ -\log[H^+] = -\log[A^-] -\log[H^+] + \log[AH] $ $ -\log[H^+] = -\log[A^-] -\log[H^+] + \log[AH] $](/latexrender/pictures/ca31745a3840c8bbbacef920f886d600.png)
![$ \log[AH] -\log[A^-] = 0 $ $ \log[AH] -\log[A^-] = 0 $](/latexrender/pictures/e5201bc00bb8e1764b69ae43908424fe.png)
![$ \log[AH] = \log[A^-] $ $ \log[AH] = \log[A^-] $](/latexrender/pictures/4f08e1388efd5ed1f3c1f21db3e368ac.png)
![$ [AH] =[A^-]$ $ [AH] =[A^-]$](/latexrender/pictures/1a491666cb2886cc65ba88ecce0f3583.png)