Certaines réactions sont si rapides qu'elles paraissent instantanées ; c'est la cas de nombreuses réactions redox, et de nombreuses réactions acido-basiques, par exemple.
Pour d'autres réactions, la vitesse est mesurable, et on peut constater l'avancement progressif de la réaction.
DÉFINITION DE L'AVANCEMENT D'UNE RÉACTION
La définition intuitive de la vitesse d'une réaction chimique est : l'augmentation de la concentration des produits pendant un temps donné, soit : d[P]/dt (où P est un produit de la réaction). Problème : lorsqu'une réaction a plusieurs produits, dont les coefficients stoechiométriques sont différents (exemple : le réactif R donne les produits P1 et P2 selon l'équation-bilan : R -> 2 P1 + 3 P2) : la concentration d'un des produits (ici : P2) augmentera plus vite que celle des autres (ici, la concentration de P2 augmente 1,5 fois plus vite que celle de P1).
Comment choisir le produit avec lequel on va définir la vitesse de la réaction ?
On introduit donc
l'avancement de la réaction : c'est la valeur
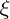
telle que :
![$ \frac {d \xi} {dt} = \frac {1}{n_i} . \frac{d[P_i]}{dt}$ $ \frac {d \xi} {dt} = \frac {1}{n_i} . \frac{d[P_i]}{dt}$](/latexrender/pictures/bfcda6d114691a9c109705ee309a96cb.png)
avec
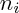
: coefficient stoechiométrique du produit
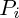
.
Cette valeur
ne dépend plus du choix du produit
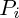
.
On peut aussi l'appliquer aux réactifs de la réaction : on a en effet :
![$ \frac{d \xi } {dt} = \frac{-1}{n_i} . \frac {d[R_i]}{dt} $ $ \frac{d \xi } {dt} = \frac{-1}{n_i} . \frac {d[R_i]}{dt} $](/latexrender/pictures/5bca820019a3aa283d6150256679b12e.png)
avec
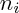
: coefficient stoechiométrique du réactif

.
La vitesse de la réaction est alors définie comme :
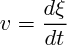
PARAMÈTRES INFLUENÇANT LA VITESSE D'UNE RÉACTION
Pour une réaction donnée, la vitesse dépend :
- des concentrations des différents réactifs et produits
- de la température
- de la présence éventuelle de catalyseurs.
Les
catalyseurs sont des entités chimiques qui participent à la réaction, mais qui n'apparaissent pas dans l'équation-bilan : elles sont consommées par la réaction, mais également formées (dans les mêmes quantités) par la réaction. En leur présence, la réaction est accélérée.
Exemples de catalyseurs :
ce peut être des solides, dont la surface réagit avec un (ou plusieurs) réactif(s) de la réaction ; ensuite, d'autres réactifs de la réaction réagissent avec la molécule de réactif fixée sur le solide, ce qui libère le solide (exemple : le platine, qu'on utilise pour accélérer les réactions d'hydrogénation des alcènes :
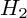
commence par se fixer sur le platine, la liaison
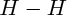
est rompue, et deux liaisons
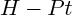
sont formées ; l'alcène réagit ensuite avec cette forme " activée " de
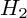
, ce qui libère le
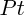
dans son état initial). Autre exemple de catalyseur : les enzymes : ce sont des macromolécules biologiques (la plupart sont des protéines), qui, par des interactions faibles, non covalentes, avec les réactifs, rapprochent les molécules de réactifs de la réaction, et les orientent correctement l'une par rapport à l'autre, ce qui favorise la réaction.
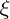 telle que :
telle que : ![$ \frac {d \xi} {dt} = \frac {1}{n_i} . \frac{d[P_i]}{dt}$ $ \frac {d \xi} {dt} = \frac {1}{n_i} . \frac{d[P_i]}{dt}$](/latexrender/pictures/bfcda6d114691a9c109705ee309a96cb.png)
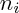 : coefficient stoechiométrique du produit
: coefficient stoechiométrique du produit 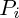 .
.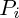 .
.![$ \frac{d \xi } {dt} = \frac{-1}{n_i} . \frac {d[R_i]}{dt} $ $ \frac{d \xi } {dt} = \frac{-1}{n_i} . \frac {d[R_i]}{dt} $](/latexrender/pictures/5bca820019a3aa283d6150256679b12e.png)
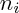 : coefficient stoechiométrique du réactif
: coefficient stoechiométrique du réactif  .
.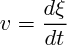
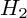 commence par se fixer sur le platine, la liaison
commence par se fixer sur le platine, la liaison 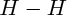 est rompue, et deux liaisons
est rompue, et deux liaisons 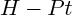 sont formées ; l'alcène réagit ensuite avec cette forme " activée " de
sont formées ; l'alcène réagit ensuite avec cette forme " activée " de 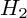 , ce qui libère le
, ce qui libère le 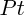 dans son état initial). Autre exemple de catalyseur : les enzymes : ce sont des macromolécules biologiques (la plupart sont des protéines), qui, par des interactions faibles, non covalentes, avec les réactifs, rapprochent les molécules de réactifs de la réaction, et les orientent correctement l'une par rapport à l'autre, ce qui favorise la réaction.
dans son état initial). Autre exemple de catalyseur : les enzymes : ce sont des macromolécules biologiques (la plupart sont des protéines), qui, par des interactions faibles, non covalentes, avec les réactifs, rapprochent les molécules de réactifs de la réaction, et les orientent correctement l'une par rapport à l'autre, ce qui favorise la réaction.