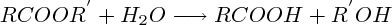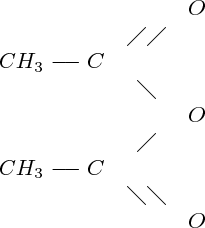LES ESTERS
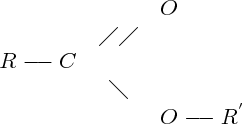
La fonction ester est la fonction :
Fabrication des esters : la réaction d'estérification
On peut fabriquer l'ester RCOOR' en faisant réagir l'acide carboxylique RCOOH sur l'alcool R'OH ; cette réaction est catalysée par H
+, donc par les acides (en particulier, les acides forts) ; elle libère une molécule d'eau.
Cette réaction est lente (d'où l'intérêt des catalyseurs), et généralement équilibrée : à l'état d'équilibre, il reste une proportion notable d'acide carboxylique et d'alcool. Origine : la réaction d'estérification est contrebalancée par la réaction inverse :
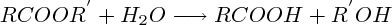
La réaction d' " hydrolyse ". Ces deux réactions se déroulent à des vitesses comparables, ce qui explique que toutes les espèces (ester, acide carboxylique, alcool) se retrouvent en solution à l'équilibre.
PARFUMS ET SAVONS
La plupart des parfums sont des esters, ce qui justifie une partie de l'intérêt industriel de la réaction d'estérification ; d'autre part, les savons (qui sont issus d'acides carboxyliques à longue chaîne carbonée ; ces acides sont appelés " acides gras ") sont obtenus par
hydrolyse des esters d'acide gras, très abondants dans la nature : en effet, les lipides (qu'on retrouve dans tous les corps gras naturels : huiles, suif, ...) sont des esters d'acides gras (d'où leur nom d' " acides gras ... ") ; il suffit donc d'hydrolyser des matières grasses pour libérer les acides gras, et les alcools. Pour les glycérides (une classe de lipides), cet alcool est le glycérol (ou : glycérine), aux nombreuses applications en synthèse également.
La réaction de saponification (" fabrication du savon ") est donc une hydrolyse de glycérides, qui libère du glycérol, et des acides gras ; la réaction est catalysée par une base forte (en général : la soude NaOH ou la potasse KOH). Comme tout catalyseur, cette base forte est régénérée après la réaction d'hydrolyse ; cependant, comme la réaction d'hydrolyse a libéré un acide carboxylique, cet acide réagit avec la base forte, pour donner un carboxylate (base conjuguée de l'acide carboxylique). De fait, la base forte est consommée par une réaction en aval de l'hydrolyse : il faut donc rajouter de la soude aux réactifs, pour maintenir la catalyse.
Les savons sont des sels de ces carboxylates, avec des cations.
Physico-chimie des savons
Les savons possèdent donc une longue chaîne carbonée, terminée par une fonction carboxylate COO
- ; la chaîne carbonée est constituée uniquement d'atomes C et H, qui sont très peu polarisés : ils ne peuvent donc pas établir de liaisons hydrogène avec l'eau. La chaîne carbonée est donc dite " hydrophobe ". En revanche, la fonction COO
-, qui est chargée électriquement, établit des liaisons avec les molécules d'eau : elle est dite " hydrophile ".
Conséquence : dans l'eau, les savons ont tendance à s'organiser autour des particules hydrophobes de la manière suivante :
- la chaîne hydrophobe interagit avec les particules hydrophobes (exemple de particules hydrophobes : celles qui constituent une tache de gras sur un vêtement)
- la tête hydrophile interagit avec le solvant, l'eau.
Si on agite, les particules hydrophobes se décollent de leur support (par exemple : le vêtement taché), et s'entourent de molécules de savon ; les molécules de savon présentent leur tête hydrophile aux molécules d'eau. Ainsi
, le savon aide à décrocher les particules hydrophobes de leur support (sans le savon pour les stabiliser, elles ne seraient pas allées dans la phase aqueuse) ; de tels composés, qui aident à décrocher les particules hydrophobes même en solution aqueuse, sont appelés " détergents ".
Auto-organisation des savons
La chaîne hydrophobe de la molécule de savon n'interagit pas avec l'eau ; toutes les chaînes hydrophobes tendent donc à se regrouper, en excluant les molécules d'eau ; la particule ainsi formée présente alors les têtes hydrophiles à la phase aqueuse, alors que les chaînes hydrophobes sont masquées. De telles particules sont appelées " micelles ".
SYNTHÈSE DE L'ASPIRINE
La dernière étape de la synthèse de l'aspirine est une estérification : c'est la réaction de l'acide salicylique (acide hydroxy-2 benzoïque) sur l'anhydride éthanoïque ; c'est l'acide salicylique qui joue le rôle de l'alcool (il porte certes une fonction acide, mais aussi une fonction alcool ...) ; on utilise l'anhydride éthanoïque
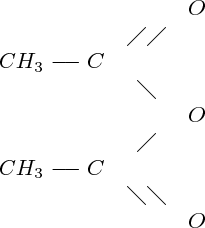
plutôt que l'acide éthanoïque, pour
s'affranchir de la réaction d'hydrolyse, réaction inverse de l'estérification, qui fait donc diminuer le rendement de la réaction : en effet, les anhydrides d'acides sont capables de remplacer les acides carboxyliques dans la réaction d'estérification, mais dans ce cas, la réaction ne libère pas de molécule d'eau : en réalisant cette réaction en l'absence d'eau, il est donc possible d'empêcher complètement la réalisation de la réaction d'hydrolyse (puisqu'il lui manque un réactif : H
2O), ce qui améliore le rendement de la synthèse.